HIGIENE OCUPACIONAL...
American Board of Industrial Hygiene

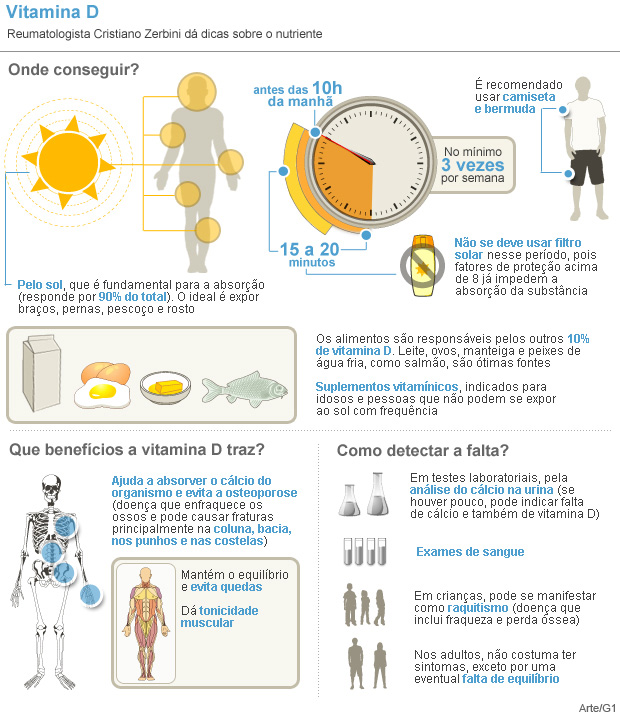
Higiene do trabalho ou higiene ocupacional é um conjunto de medidas preventivas relacionadas ao ambiente do trabalho, visando a redução de acidentes de trabalho e doenças ocupacionais. A higiene do trabalho consiste em combater as doenças profissionais.
Uma das atividades da higiene do trabalho é a análise ergonômica do ambiente de trabalho, não apenas para identificar fatores que possam prejudicar a saúde do trabalhador e no pagamento de adicional de insalubridade/periculosidade, mas para eliminação ou controlar esses riscos, e para a redução do absenteísmo (doença).
A capacidade analítica desenvolvida nesse esforço permite ir além, na forma de identificação e proposição de mudanças no ambiente e organização do trabalho que resultem também no aumento da produtividade, e da motivação e satisfação do trabalhador que resultem na redução de outros tipos de absenteísmo que não relacionado às doenças.

Higiene Ocupacional utiliza estratégias para avaliação da exposição a contaminantes atmosféricos que ofereçam riscos ocupacionais. O método de trabalho ocupacional inclui as seguintes etapas: antecipação do risco, a identificação de riscos potenciais antes que eles venham a se tornar um risco real; identificação do risco, com estabelecimento da relação dose-resposta; avaliação da exposição com caracterização do risco; e controle dos mesmos, com implantação de mecanismos corretivos ou prevencionistas.
É preciso considerar que o progresso gerado pelo trabalho nem sempre precisa estar associado com prejuízo para a saúde do trabalhador, pois os riscos ocupacionais podem e devem ser controlados pela atividade da higiene ocupacional, quase sempre através da implantação de programas prevencionistas.
A Higiene Ocupacional cuida do ambiente de trabalho para prevenir doenças ou
lesões nos trabalhadores, provenientes de atividades em ambientes de trabalho
com calor, ruído, vibração, manuseio de substâncias químicas, bioaresóis,
agrotóxicos etc. É uma especialização de importância crescente pois a
conscientização de que o ambiente de trabalho não deve causar danos à saúde do
trabalhador tem se imposto, infelizmente, à custa de muitas vidas.
Segundo a
Organização Internacional do Trabalho (OIT) quase 2 em cada 3 trabalha-dores no
mundo inteiro estão expostos à substâncias químicas, estimando-se que 1,5 a 2
bilhões de pessoas são afetadas.
Devido à sua abrangência podem
trabalhar nesta especialização profissionais de todas as áreas do conheci-mento
(médicos do trabalho, enfermeiras do trabalho, físicos, biólogos, psicólogos e
engenheiros químicos etc.).

Os trabalhadores podem encontrar
no ambiente de trabalho. devido a inalação de ar impróprio, situações muito
perigosas. Por exemplo, respirar ar contaminado acima da cha-mada concentração
Imediatamente Perigosa a Vida ou à Saúde (IPVS) (por exemplo, 1500 ppm de
monóxido de carbono. 50.000 ppm de gás carbônico, 500 ppm de gás sulfídrico.
etc) produzem efeitos agudos irreversíveis à saúde, ou até morte imediata,
dependendo das circunstâncias. Inalar ar com deficiência de Oxigênio produz as
mesmas consequências quando a concentração do 02 no ar cai abaixo de
12,5%, ao nível do mar ( significa que a pressão parcial de 02 no ar
é menor que 95 mm de Hg) (1), isto é, o ambiente também é considerado IPVS.
Nestes casos a vítima perde a coordenação motora, tem a sua
capacidade de julgamento muito reduzida e ocorrem lesões irreversíveis no
coração e se não for resgatada imediatamente morrerá em alguns minutos. Mesmo
resgatada, apresentará problemas de saúde pelo resto da vida, devidos as lesões
cerebrais e no músculo cardíaco.
Veremos dois
casos verídicos onde o perigo está na deficiência de 02. No primeiro
exemplo, morreu um trabalhador e, no outro, se não for tomada alguma
provi-dência, poderá morrer mais um.
Outro ponto que pode ser
destacado é a possibilidade de muitas situações de risco poderem ser previstas
desde que o profissional tenha um sólido conhecimento de disciplinas básicas,
como química, física etc.

Caso 1 Um trabalhador foi escalado para pintar uma válvula do tipo gaveta, de
grandes dimensões localizada numa rua pública no fundo de um poço de visita com
1,2 m de diâmetro por 3,5 m de profundidade. Uma testemunha do ocorrido contou
que viu o trabalhador levantar a tampa de ferro e descer pela escada de serviço
que também era de ferro, fixa na parede do poço. Imediatamente subiu, como que
para tomar ar, e após uma pausa desceu novamente. A testemunha, por curiosidade,
foi olhar o poço que era bem iluminado pela luz natural, viu o trabalhador
caído, imóvel no fundo do poço. A equipe de res-gate chegou logo e, usando
mascaras autônomas como é usual nestes casos, recolheu a vítima que morreu ao
dar entrada no hospital.
A autópsia
descartou, como causa mortis, o envenena-mento por monóxido de carbono ou
por queda. A perícia efetuada no local do acidente observou uma grande
quantidade de ferrugem no fundo do poço e nas superfícies metálicas que deveriam
ser limpas, lixadas e pintadas. Após duas horas do acidente foi constatado que o
teor de O2 no ar ambiente do poço era igual a 17%. Este teor baixo de
O2 levou à suspeita de que no momento do acidente o teor de
O2 seria bem mais baixo, inclusive menor do que 12,5%, pois a
operação de resgate provavelmente alterou as condições iniciais. Também não foi
detectada a presença de qualquer outro gás que pudesse reduzir o teor de
O2. Assim, a hipótese mais provável seria o consumo de O2
pela reação de oxidação com o ferro!
Para testar a hipótese do
oxigênio do ar que existia no poço ter sido consumido devido à formação de
ferrugem, foi colocado um pedaço de degrau de ferro, polido, num tubo de ensaio
contendo ar ambiente, bem fechado e ligado a um manômetro diferencial, conforme
a figura 1. Após um longo tempo a pressão dentro do tubo de ensaio caiu de 760
mm Hg para 660 mm de Hg. Portanto a pressão dentro do tubo caiu 100 mm de Hg.
Como é somente o Oxigênio que reage com o ferro, pode-se dizer que a pressão
parcial do Oxigênio se reduziu de 100 mm Hg ou, lembrando que o ar tem 21% de
Oxigênio, caiu para:
760x0,21-100 = 59,6 mm de
Hg
O teor de Oxigênio será
então:
59,6/660x100 =
9%
Observe que esse valor é menor
do que o IPVS de 12,5%, explicando a queda instantânea do trabalhador no
poço.

Fig. 1 Esquema
do sistema para verificar a ação do ferro.
Se a empresa tivesse normas de procedimentos para a execução de tais serviços, como verificar a presença de risco de explosão devido à presença de gases ou vapores inflamá-veis, medir o teor de Oxigênio, insuflar ar limpo no fundo do poço antes da entrada de alguém, não teria ocorrido o acidente. Se os responsáveis pela elaboração dessas normas conheces-sem química, levariam em conta a avidez do ferro pelo oxigênio. Basta fazer a experiência de colocar fogo em um pe-daço de palha de aço; observa-se um bonito espetáculo piro-técnico.Caso 2 Numa fábrica de refrigerantes o controle de qualidade das tampinhas é feita em uma pequena sala (2X1,5X2,5 m) com uma única porta, sem janelas, nem ventilação forçada. As garrafas ensaiadas com as tampinhas são cheias com Nitrogê-nio proveniente de um conjunto de dois cilindros interconec-tados, que ficam dentro da sala, com volume de 8 litros cada um e pressão de 200 bar. Particularmente nesta indústria não aconteceu nenhum acidente, mas o risco potencial existe. A pergunta que um agente de segurança fez durante um curso de Proteção Respiratória ao tomar conhecimento sobre situações IPVS decorrente da deficiência de Oxigênio foi: seria atingido o nível IPVS se o cilindro vazasse na pequena sala? Para poder responder esta pergunta é preciso saber qual a quantidade em massa de N2 contida no recipiente de nitrogênio. Aí entra a velha e não tão querida Termodinâmica.Vamos admitir que o ambiente da sala esteja a 25o C e 1 atm. A quantidade de Nitrogênio no cilindro a 25oC e 200 bar pode ser calculada pela equação de estado generalizada:
PV
= znRT
O valor de z pode ser encontrado em tabelas de fator de compressibilidade (1), a 25o C e 200 bar z = 1,02. Assim o número de mols de nitrogênio contido no cilindro será:n = 194 atm.16 l/(1,02.0,082(atm.l/K.mol).298K)n = 124,6 mols(1 atm = 1,033 bar)Nas condições da pequena sala, o nitrogênio que deixa os recipientes pode ocupar o volume do ar de dois modos diferentes: a) se o vazamento fosse muito lento daria tempo para o nitrogênio se misturar com o ar como indicado na Fig. 2, provocando uma “mistura perfeita”. O teor de Nitrogênio na sala é variável e crescente com o tempo.

Fig. 2 Modelo de mistura
perfeita
b) Por outro lado, se o vazamento fosse rápido, não daria para o nitrogênio se misturar e empurraria o ar para fora permanecendo totalmente dentro da sala, é o modelo “pistonado”, como pode ser observado na Fig. 3.

Fig. 3 Modelo de mistura
pistonado
Para saber qual a concentração de Nitrogênio na peque-na sala quando todo o cilindro vazou no caso do modelo de mistura perfeita, faz-se um balanço molar de Nitrogênio no volume de controle indicado na Fig. 4:

Fig. 4 Volume
de controle para o balanço de Nitrogênio.
Entra - Sai + Produção = Variação
supondo que a corrente de vazamento dos cilindros seja constante, então a corrente de entrada é composta de nitrogênio puro, a corrente de saída tem uma concentração de nitrogênio igual à concentração de dentro da sala pois a mistura é perfeita
. Não há produção de nitrogênio dentro da sala por reação química. Pode-se escrever:

onde x é a fração molar de Nitrogênio dentro da sala, n o número total de mols de gás dentro da sala e é o tempo.Supondo que a vazão molar de entrada de nitrogênio na sala seja igual à vazão molar de saída de ar da sala e que o número total de mols da sala não se altere, tem-se:


rearranjando:

integrando:

lembrar que no início do vazamento, instante 0, o ar da sala tem a concentração normal de Nitrogênio, 79 %. Resolvendo a integral:

o número total n de mols contidos na sala pode ser calculado por Clapeyron:

O produtoé constante e igual à quantidade de mols dentro dos cilindros, 124,6 mols. Substituindo, tem-se:
A concentração é de 14%, muito perto da concentração de IPVS! Nesse ambiente ocorre fadiga anormal, perturbação emocional. Perda de coordenação motora e a pessoa tem pequena capacidade de julgamento.Analisando a hipótese do modelo pistonado o volume de nitrogênio que escapou dos cilindros nas condições da sala é:V = n.R.T/PV = 124,6.0,082.298/1V = 3044 lsendo o volume da sala 7,5 m3 o volume de ar na sala depois do vazamento de nitrogênio é:7,5 -3,04 = 4,46 m3;Imaginando que o nitrogênio vazado expulse o ar da sala ocupando o seu lugar, o volume total de nitrogênio na sala nitrogênio remanescente do ar (79% em volume) que ficou mais nitrogênio do vazamento será:4,46.0,79 + 3,04 = 6,56 m3e o teor de nitrogênio na sala:6,56/7,5x100 = 87,5%Portanto, o teor de oxigênio na sala: 100-87,5 = 12,5%O IPVS seria atingido e sem perceber o trabalhador esta- ria em risco de vida. O segundo caso seria a situação mais perigosa, provavelmente ocorre algo intermediário entre os dois casos.Com alguns cálculos simples foi possível prever um ambiente de alto risco. Esse conhecimento mínimo pode fazer a diferença entre a vida e a morte de alguém!Para mostrar que a história se repete, os jornais anunciaram há alguns meses o acidente em que morreram, um enge-nheiro e um operário da Comgás que examinava uma tubu-lação que estava sendo testada quanto à vazamentos. O teste consistia em pressurizar a tubulação com Nitrogênio. A tubu-lação se encontrava dentro de uma vala de muitos quilômetros de comprimento e como havia vazamentos pelas soldas, o Ni-trogênio saiu e se concentrou nesta vala onde atingiu redu-zindo o teor de Oxigênio abaixo de 12,5%!
FONTE:(1) Torloni, M. Programa de Proteção Respiratória: recomendações; seleção e uso de respiradores. São Paulo . Fundacentro, 1995.
(2) Hougen, O. A., Watson, K. M., Ragatz, R. A. Princípios dos Processos Químicos, Livraria Lopes da Silva 1973.